
期刊:Cell discovery
影响因子:13.0
主要技术:scRNA-seq、scATAC-seq
导语
人类小脑包含多种神经元,与大脑的发育模式完全不同。本研究通过scRNA-seq,scATAC-seq 和空间转录组学分析了孕周(GW)13-18周的胎儿样本,探索发展中的人类小脑细胞多样性和发育程序。作者鉴定了跨物种保守的暂时性颗粒细胞祖细胞,并从多个角度对颗粒细胞(GC)和浦肯野细胞的特殊模式进行了解剖,并在凌唇中发现了一个新的潜在神经上皮细胞群。此外,作者多角度对比了各神经亚型的物种保守性。最后,作者解析了浦肯野细胞和单极刷状细胞的各亚型的分子特征,并揭示了控制其多样化的基因调控网络。本研究提供了一个人胎儿小脑的多组学图谱,加深了我们对人类小脑的发育和空间组织的理解。
主要技术
scRNA-seq、scATAC-seq
主要结果
1. 发育中的人类小脑的多组学分析
作者选取GW13-18周的胎儿小脑样本进行scRNA-seq、空间转录组学分析(Stereo-seq)以及scATAC-seq。从62,247个高质量细胞中鉴定了GABA能神经元(如中间神经元、浦肯野前体细胞)、兴奋性谱系细胞(如未成熟颗粒细胞、颗粒细胞祖细胞)以及HES1+祖细胞和胶质细胞,并识别了各细胞类型的特异性标记基因。RNA速率分析揭示了祖细胞分化轨迹,ATOH1+兴奋性祖细胞(颗粒细胞系)在增殖期高表达G2/M期标志物(如TOP2A),而PTF1A+祖细胞比例较低;浦肯野前体细胞(PKCs)在GW13占比最高,随后迅速减少,而未成熟颗粒细胞(UBCs)占比在GW16达到峰值。空间转录组学显示GW13样本中细胞类型呈多层环状分布(如外颗粒层、内颗粒层),GW16样本中可区分菱唇、浦肯野细胞层及核团区域,与解剖结构一致。scATAC-seq与scRNA-seq数据整合分析表明染色质可及性与基因表达谱高度相关。
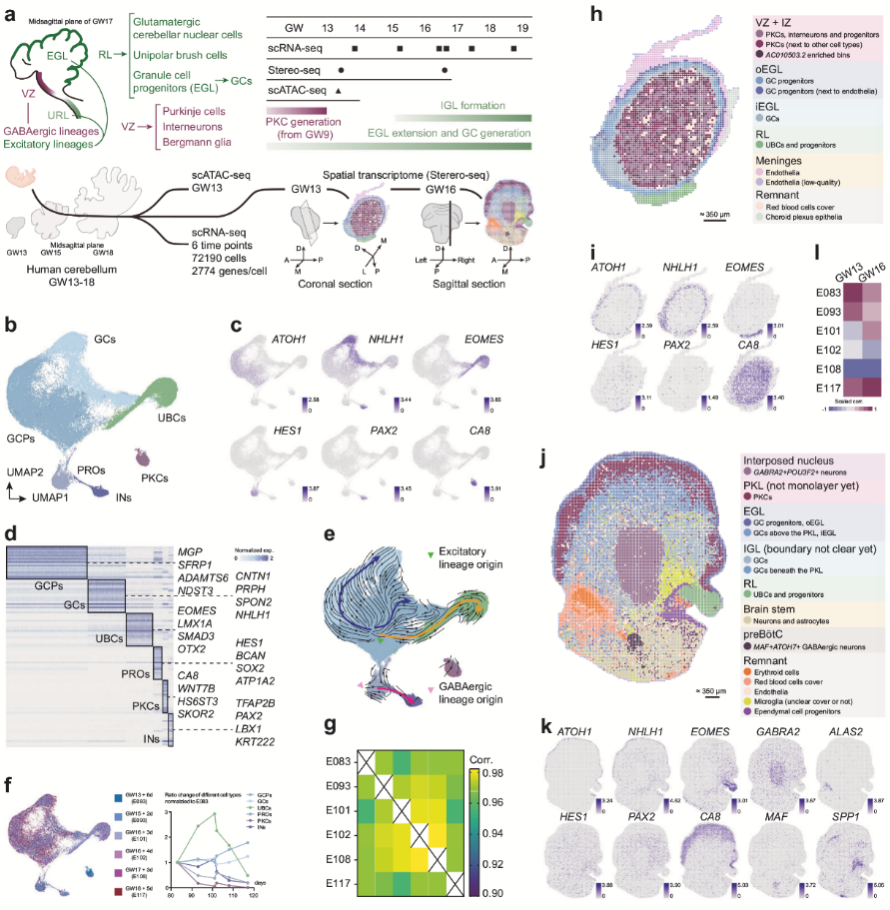
图1 人类发育小脑的多组学分析
2. GC谱系的发育轨迹和瞬时扩增祖细胞
NRN1+小脑兴奋性神经元中,GC占比最高,随后作者从多方面解析了GC的发育。通过细胞周期评分和拟时序分析,作者将GC谱系分为 增殖期祖细胞(AT+GCPs和ND+GCPs) 和后分裂成熟GCs。其中ND+GCPs(NEUROD1+祖细胞)具有增殖特征(表达S/G2/M期标志物),与AT+GCPs相比不表达SOX2,高表达ELAVL2,且在小鼠中具有跨物种保守性。NEUROD1 的表达早于其他成熟GC标记基因,可能在早期驱动分化。空间转录组数据揭示了 ND+GCPs与AT+GCPs的“内-外”分层分布(iEGL和oEGL),与小鼠中瞬时扩增祖细胞的空间定位一致。后分裂GCs特异性表达 PRPH(神经元中间丝蛋白),仅在iEGL表达,可作为iEGL标志物;而 SFRP1 与PRPH表达互补,提示功能分化。CPLX3(前iEGL特异性)和 SV2B(iEGL富集)参与神经递质分泌调控,可能与PRPH形成蛋白互作网络,协同调控GC迁移。整合多组学构建基因调控网络,鉴定出 ATOH1、YBX3和MEF2C 等关键转录因子。 ND+GCPs中 Ras/Rap1信号通路 和趋化因子激活,调控神经分化形态变化,且该通路在人类和小鼠中保守。
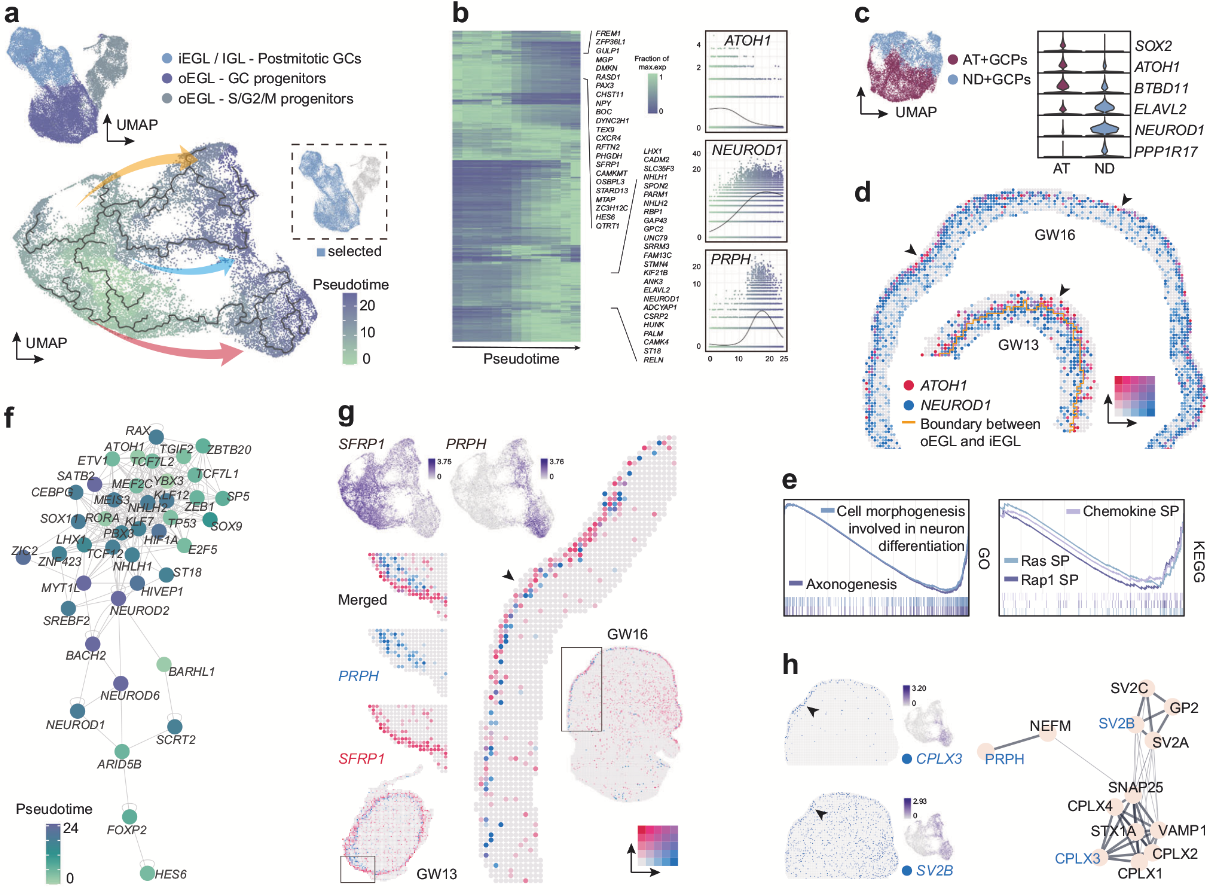
图2. GC亚群发育轨迹和EGL祖细胞亚型分析
3. GC亚群特征及其空间分布
小脑不同区域(如前叶、后叶、绒球小结叶)表现出独特的基因表达模式。例如,BARHL1和TLX3在颗粒细胞祖细胞中互斥表达,分别在小脑前部和后部区域高表达。空转数据显示,EBF2和HEY1富集于背内侧区域(可能与蚓部相关),而PRR35在腹外侧区域(半球)表达,揭示了颗粒细胞在前后轴(A-P)和背内侧-腹外侧轴(DM-VL)的异质性。单细胞数据显示,TLX3在人类后叶和绒球小结叶均表达,但在小鼠中仅在后叶出现;PARM1在人类后叶和小鼠前叶富集,呈现相反的分布模式。这种差异提示小脑发育的分子机制可能存在物种特异性演化。整合单细胞多组学数据(scRNA-seq和scATAC-seq)发现,A-P轴分布受特定转录因子调控,这些因子可能通过调控增强子活性驱动区域特异性基因表达。
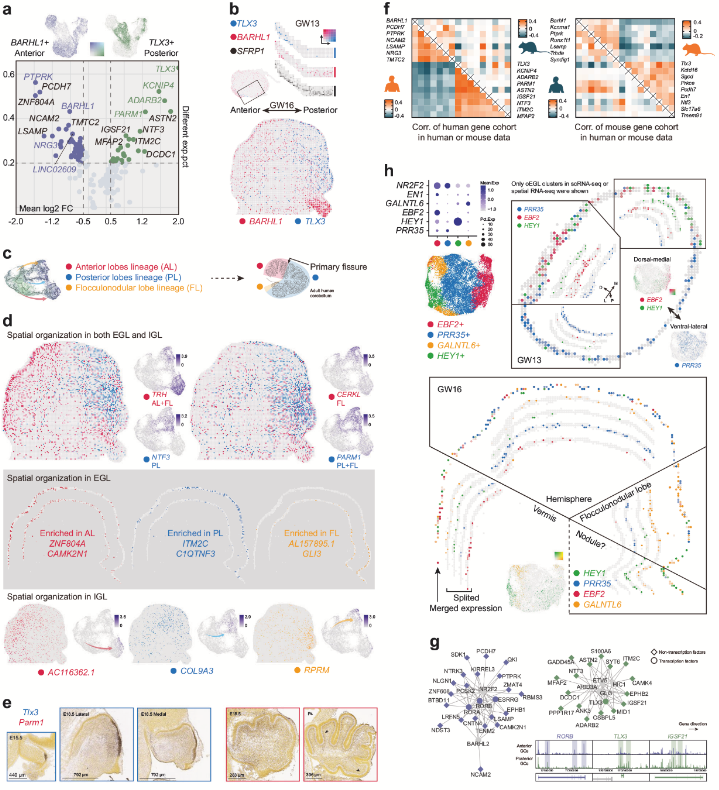
图3 GC 亚群的空间分布和基因表达特征
4. UBC谱系发育
UBC和GC都被认为是从菱形唇(RL)中的WLS+祖细胞产生的神经元谱系。作者鉴定出一类新型潜在神经上皮细胞群(UBCpro-1),高表达COL2A1、PIK3C2G及干性标记物(如SOX2、CYP26B1)。空转数据显示,COL2A1高表达于最内侧区域,与CALCB(RL腹侧区标记)和EOMES(RL亚脑室区标记)形成“由内向外”的分布模式,作者推测UBCpro-1可能分化为经典的WLS+CALCB+ UBC祖细胞(UBCpro-2)。此外,作者还发现了UBC的两种潜在亚型:1. LMX1A+ UBC:与已知的GRM1+ UBC(谷氨酸能)特征相似;2. CNTNAP5+ UBC:可能为未成熟的CALB2+ UBC,高表达胆碱能突触通路相关基因。EOMES和PBX3可能是控制所有UBC谱系分化的核心调节剂,而SP5可能对CNTNAP5+谱系的发展至关重要,且具有物种保守性。
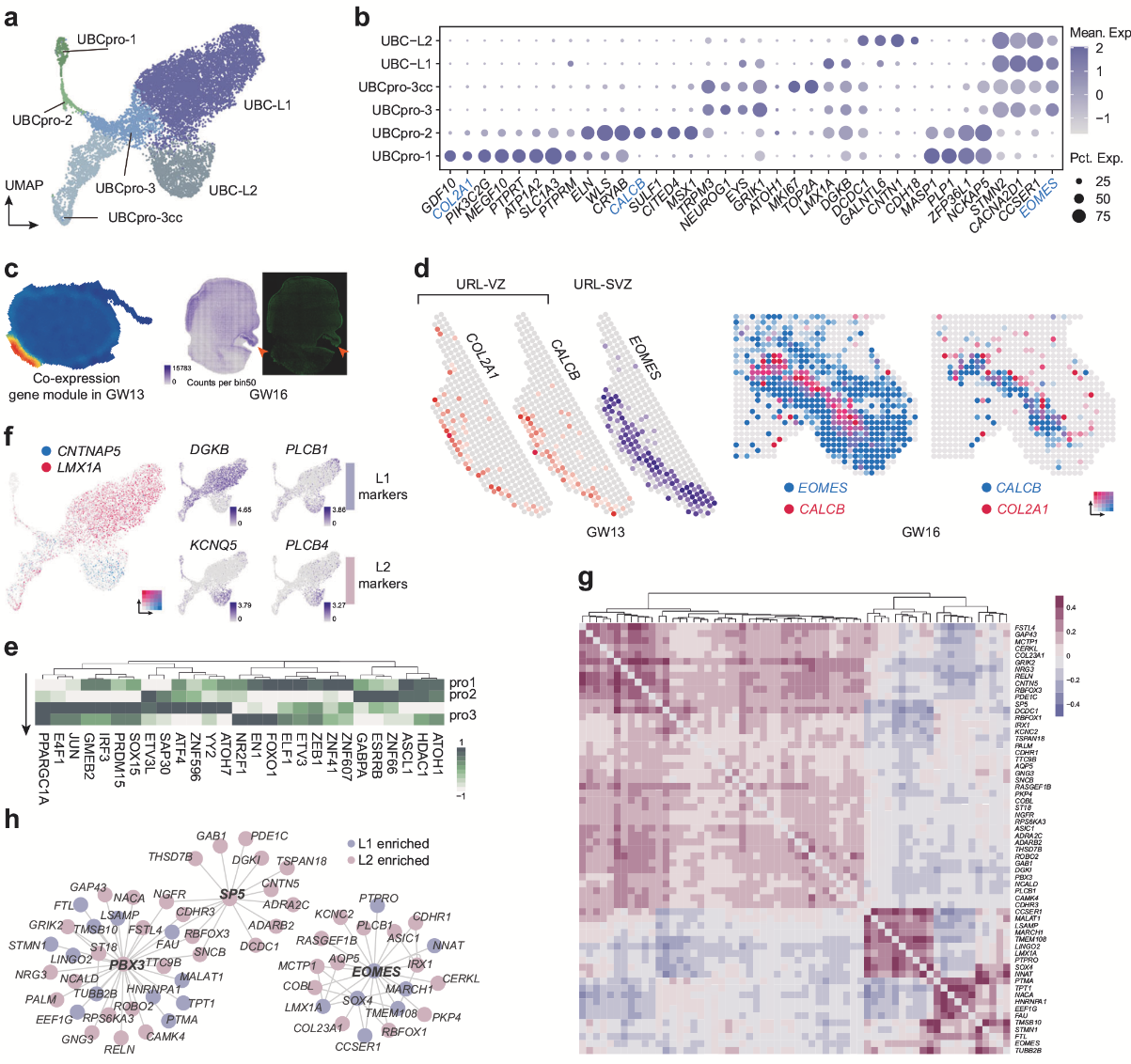
图4 UBC祖细胞和UBC亚型的调控网络
5. VZ祖细胞与中间神经元发育
VZ可以产生多种类型的GABA能神经元,如PKC。除神经元外,VZ还生成非神经元细胞,如OLIG2+PDGFRA+少突胶质祖细胞,PIFO+RSPH1+室管膜祖细胞,Bergmann胶质细胞等。PKC在小脑回路中执行关键功能,本研究发现3种PKC分子亚型:PKC1:表达EBF2和IGF1,对应已知的Zebrin II阴性亚型;PKC2:表达LSAMP、PCP4L1;PKC3:表达SLA、PBX3和FGF3。作者推测PKC2与PKC3均属于Zebrin II阳性亚型。POSTN(促进神经突生长)和IGSF21(调控抑制性突触分化)沿A-P轴呈互补分布,暗示小脑前后区域PKCs的功能分化或发育差异。早期发育中CADM1(腹侧富集)与PLCB4/CADM2(背侧)沿D-V轴分离(人类GW13和小鼠E15.5均存在),但后期(GW16)逐渐模糊。此外CADM1作为自闭症相关基因,其缺失可能导致小脑体积缩小及PKC突触减少,提示其在早期PKC空间组织中的潜在作用。整合scRNA-seq与scATAC-seq数据发现,EBF2通过远端增强子激活SEMA3A,与小鼠中Ebf2缺失导致Sema3a+ PKCs减少的结果一致,而NR2F2和ZNF664可能参与不同PKC亚型的分化调控。
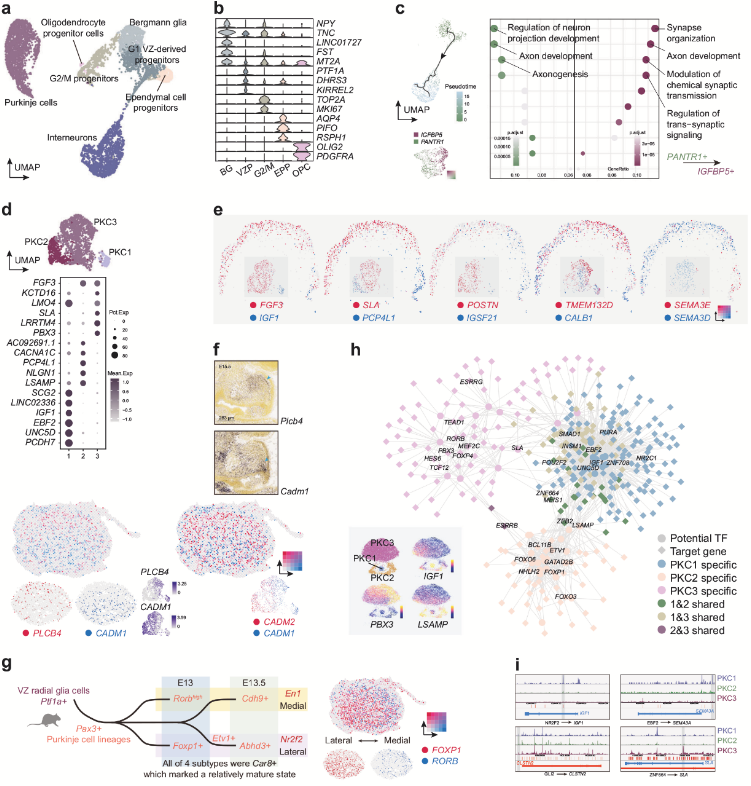
图5 中间神经元谱系和PKC亚型的分子特征
参考文献:
[1] Yang F, Zhao Z, Zhang D, Xiong Y, Dong X, Wang Y, Yang M, Pan T, Liu C, Liu K, Lin Y, Liu Y, Tu Q, Dang Y, Xia M, Mi D, Zhou W and Xu Z 2024 Single-cell multi-omics analysis of lineage development and spatial organization in the human fetal cerebellum Cell Discov 10 22.
