想精准诱导RAW264.7成为促炎的M1“战士”或抗炎的M2“修复者”?别找了!这份保姆级、超详细的RAW264.7细胞M1/M2极化方案,从试剂配比到操作细节,一次性打包给你!
01 必备材料清单
-
细胞:RAW264.7小鼠单核巨噬细胞系
注意:传代次数不宜过多,建议<10代
-
培养基:高糖DMEM
-
血清:胎牛血清(FBS),推荐使用10%
-
抗生素:青霉素-链霉素双抗溶液(1%)
-
关键诱导剂:
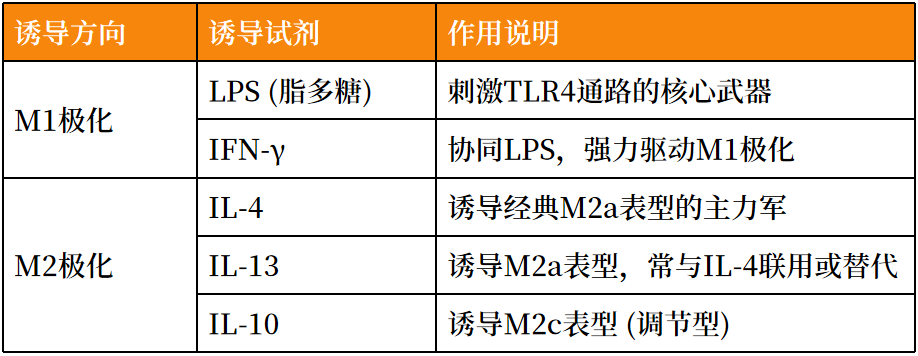
-
溶剂对照:PBS或细胞培养基(用于溶解冻干诱导剂的溶剂)
注意:所有细胞因子、LPS建议分装后-20℃或-80℃保存,避免反复冻融!使用前务必在冰上或4℃缓慢溶解,并用预冷的培养基或PBS稀释至工作浓度。
02 实战操作步骤[1,2] (以6孔板为例)
- 消化处于对数生长期的RAW264.7细胞,用含10%FBS和1%双抗的完全DMEM培养基制成单细胞悬液。
-
(关键步骤)将细胞以2~3x105cells/孔的密度接种于6孔板中,每孔加入2mL完全培养基
注意:密度过低影响状态,过高可能导致接触抑制或自发分化
- 放入37℃,5%CO2培养箱中孵育过夜(约16-24小时),让细胞充分贴壁。
- 确认细胞贴壁良好,约60-70%汇合度为最佳诱导窗口期。
-
小心吸弃孔内旧培养基。
-
(可选步骤):加入1-2mL预热的PBS,轻轻洗涤细胞表面。
注意:此步可去除残留血清及代谢废物
-
更换极化培养基:
M1组:每孔加入2mL含100ng/mL的LPS+20ng/mL的IFN-γ的完全培养基。
M2组(M2a为例):每孔加入2mL含20ng/mL的IL-4和20ng/mL的IL-13(可选项)的完全培养基。
对照组1-未处理:只加2mL新鲜完全培养基
对照组2-溶剂对照:加入含有诱导剂等体积溶剂的完全培养基。(排除溶剂本身的影响)
-
37℃,5%CO2条件下继续培养。
-
24小时是最常用且效果显著的标准时间点。
注意:根据具体实验目的(如检测早期/晚期基因、蛋白分泌),可调整至6、12、48或72小时,但需预实验验证。
诱导后24小时,可以通过以下方法验证极化表型:
Western Blot/ELISA(蛋白提取):加入适量预冷的RIPA裂解液(含蛋白酶/磷酸酶抑制剂),冰上裂解,收集裂解液。
-
Western Blot:检测iNOS,Arg1,CD206等关键蛋白表达水平
-
ELISA:检测上清液中TNF-α,IL-6(M1),CCL17,CCL22 (M2a) 等细胞因子的分泌水平
流式细胞术:用不含EDTA的胰酶消化(轻柔,时间不宜过长)或细胞刮收集细胞,用预冷的PBS(含1-2%FBS)洗涤1-2次,重悬于适量缓冲液中染色。
-
M1表面标志物:CD86,MHC-II等表达上调。
-
M2表面标志物:CD206,CD163等表达上调。
免疫荧光:在孔板内进行固定、通透和染色操作。
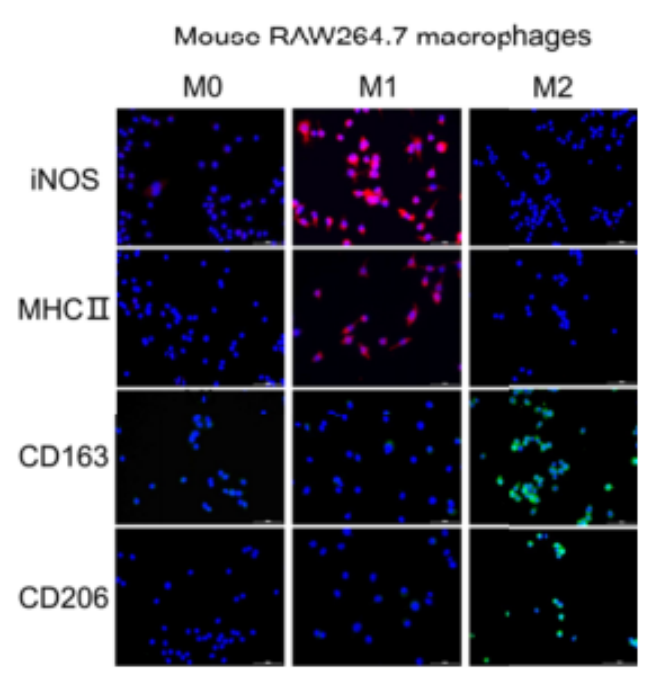
图1 采用免疫荧光染色法对 RAW264.7
巨噬细胞M1/M2 表型标志物进行检测
细胞形态(辅助观察):M1细胞常变得更圆、更亮、伪足减少;M2细胞则可能变得更拉长、铺展、类似“煎蛋”状。但这只是辅助观察,不能作为单一判定标准
注意:通常需要结合至少两种方法(如qPCR+流式)来综合判断极化是否成功且特异。
03 成功关键事项
-
诱导剂活性:细胞因子和LPS活性会随时间下降。小量分装,避免反复冻融,注意有效期。 -
细胞密度:60-70%汇合度是诱导的黄金标准。密度过高细胞易衰老,过低则反应不足。 -
设置对照:未处理组和溶剂对照组可帮你排除基础表达和溶剂效应。 -
操作轻柔:换液、洗涤时动作要轻,避免把贴壁不牢的细胞冲掉。 -
时间一致性:确保所有处理组在同一时间点收获细胞,减少时间变量带来的误差。
近岸蛋白可提供科研级IFN gamma,IL-4,IL-10,IL-13等细胞因子产品,高活性,低内毒素,助力体外巨噬细胞培养。
RAW264.7来源巨噬细胞培养因子
|
目录号 |
产品名称 |
|
C746(引用文献50+) |
Recombinant Mouse IFN gamma |
|
CK15(引用文献70+) |
Recombinant Mouse IL-4 |
|
C697(引用文献5+) |
Recombinant Mouse IL-10 |
|
CH18(引用文献5+) |
Recombinant Mouse IL-13 |
Recombinant Mouse IFN gamma (Cat#C746)
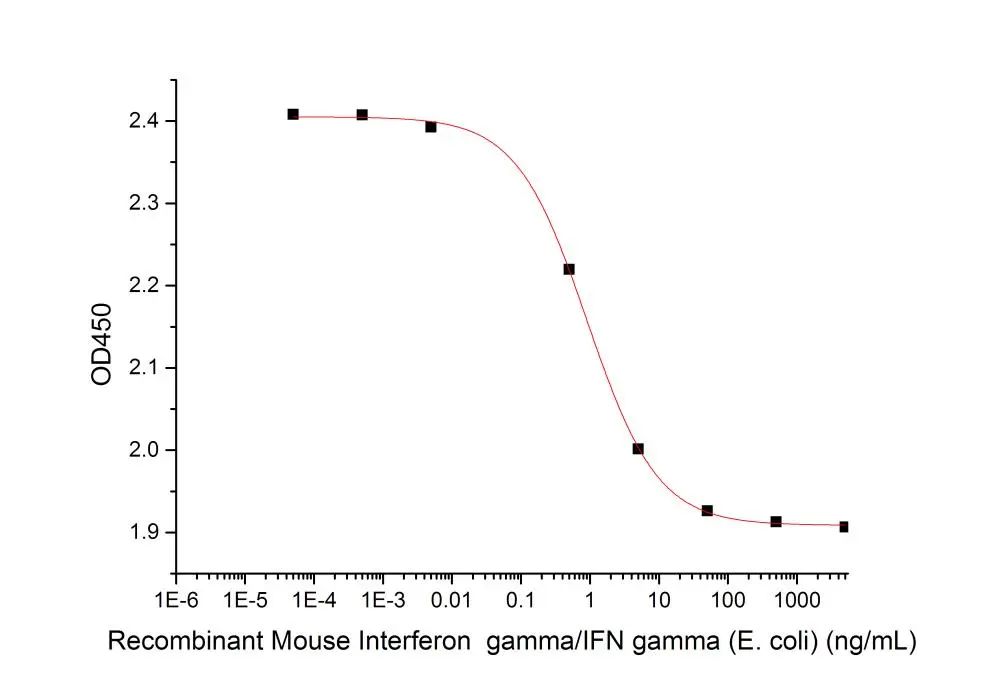
Determined by its ability to inhibit the proliferation of murine WEHI-279 cells. The expected ED50 is 1 ng/ml.
Recombinant Mouse IL-4 (Cat#CK15)
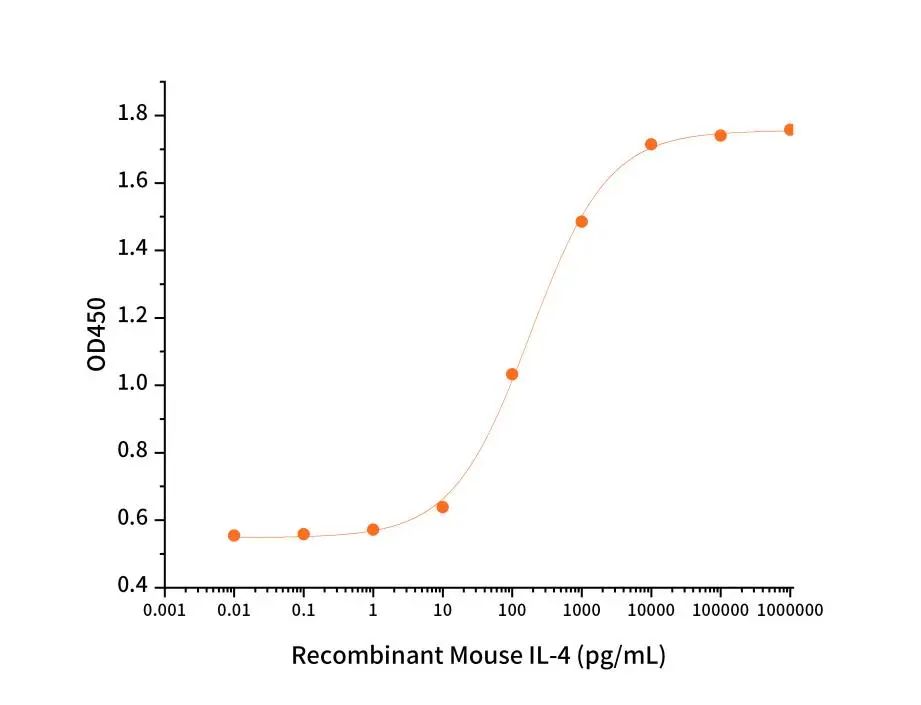
Measured in a cell proliferation assay using NFS60 mouse myelogenous leukemia lymphoblast cells.The ED50 for this effect is 182 pg/mL.
参考文献
[1]Kimbrough D, Wang SH, Wright LH, et al. HDAC inhibition helps post-MI healing by modulating macrophage polarization. J Mol Cell Cardiol. 2018;119:51-63. doi:10.1016/j.yjmcc.2018.04.011
[2]Li P, Hao Z, Wu J, et al. Comparative Proteomic Analysis of Polarized Human THP-1 and Mouse RAW264.7 Macrophages. Front Immunol. 2021;12:700009. Published 2021 Jun 29. doi:10.3389/fimmu.2021.700009
